مواد شیمیایی تنظیم کننده های pH یکی از مواد بسیار مهم در صنعت هستند. این ترکیبات معمولا اسید و باز هایی هستند که در صنایع مختلف از جمله تصفیه آب، صنایع غذایی، دارویی و… استفاده می شوند. در این مقاله توصیحی اجمالی بر خنثی سازی و روش های تعیین pH می پردازیم و در ادامه چند نمونه از مهم ترین مواد شیمیایی تنظیم کننده pH را معرفی می کنیم.
فهرست عناوین
Toggleتنظیم pH (خنثی سازی) چیست؟
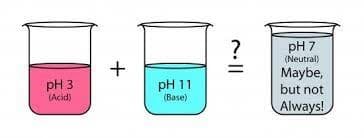
ساده ترین تعریف خنثی سازی \نتیجه واکنش یک باز و یک اسید با یکدیگر در یک فرآیند شیمیایی است.\ برای خنثی سازی اسیدها و تنظیم pH آنها، باید یون های هیدروکسید (–OH) را که معمولا در ترکیبات بازی وجود دارد، به اسید اضافه کرد. برای خنثی سازی یک باز نیز، باید یون های هیدروژن (+H) که در گروه های اسیدی موجود است، را به باز اضافه کنید است. در نتیجه واکنش خنثی سازی، آب و نمک تولید می شود. PH محلول خنثی به میزان اسید موجود در ماده اصلی بستگی خواهد داشت.
اهمیت تنظیم pH
pH نقش مهمی در زندگی همه دارد. از جمله آن می توان به تنظیم اسیدیته خونی که در بدن داریم، رشد سبزیجات و گیاهان، آبکاری فلزات و تصفیه آب اشاره کرد. بسیاری از فرآیندهای تصفیه مانند ضدعفونی کردن، لخته سازی و کنترل خوردگی وابسته به pH هستند. کلمه pH از دو کلمه potential و Hydrogen atom می آید و اشاره به تعداد یون های H+ موجود در محیط دارد. برا محاسبه آن از فرمول زیر استفاده می شود:
pH= – log10 [H+]
اساس محاسبه آن بر حسب معادله تجزیه آب است:
–H2O ↔ H+ + OH
تعادل بین پروتون و هیدروکسید تعیین کننده مقدار pH است. به طوریکه اگر –H+ ˃ OH باشد، محلول اسیدی خواهد بود. اگر–H+˂ OH باشد، محلول قلیایی است. زمانیکه تعداد یون ها برابر باشد +OH– = H محلول خنثی خواهد بود. بنابراین برای خنثی سازی یک محلول باید مقداری از اسید یا باز اضافه شود که تعداد یون ها در آن برابر شود.
چگونه یک اسید یا باز را خنثی می کنند؟
برای خنثی سازی اسید معمولا از یک باز و بالعکس استفاده می شود. گروه های H+ موجود در ترکیبات اسیدی با OH– در ترکیب بازی واکنش می دهد و آب تشکیل می دهد. در نتیجه آن تعداد پروتون ها و هیدروکسیدها کاهش یافته و pH محیط تغییر می کند. معادله کلی واکنش اسید- باز به صورت زیر است:
HA + BOH → AB + H2O
در این واکنش HA نشان دهنده اسید و BOH نشانگر باز است. AB نمک حاصل از این دو جز بوده که به صورت محلول در آب تشکیل شده است. متداول ترین مواد شیمیایی مورد استفاده برای خنثی سازی اسیدها و بازها، سدیم هیدروکسید (50%) و اسید سولفوریک (98%) است. برای بالا بردن pH مایعات اسیدی می توان از کربنات سدیم، هیدروکسید آمونیوم، هیدروکسید کلسیم یا منیزیم استفاده کرد. برای کاهش pH مایعات بازی نیز می توان از مواد شیمیایی مانند اسید فسفریک، اسید کلریدریک، اسید نیتریک یا دی اکسید کربن استفاده کرد. تمامی این مواد از حمله مواد موثر در تنظیم pH هستند.
بیشتر بخوانید: تعادل شیمیایی چیست؟
روش تعیین pH
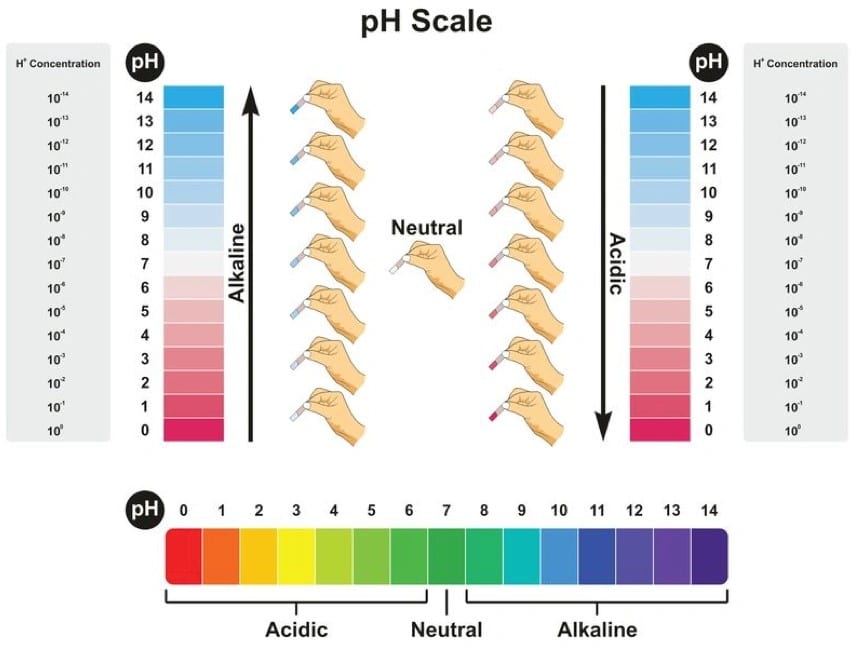
مقدار اسیدیته هر محلول آبی را می توان با استفاده pH متر تعیین کرد. مقدار pH بین صفر تا 14 است. اعداد پایین تر از 7 اسیدی بودن محیط را نشان می دهند و هر عدد کامل زیر 7، 10 برابر اسیدی تر از عدد قبلی است. به عنوان مثال pH=3 10 بار اسیدی تر از pH=4 و 100 بار اسیدی تر از 5 است. در مورد باز ها هم این موضوع درست است. به طور کلی مقادیر بالاتر از 7 نشان دهنده بازی بودن محیط است. هر pH بالاتر از 7 نیز 10 بار قلیایی تر اعداد قبلی خود است. به عنوان مثال pH=10 ده برابر قلیایی تر از pH=9 است.
دو روش کلی برای تعیین مقدار اسیدیته محلول آب وجود دارد:
- روش تقریبی: تغییر رنگ و مقایسه آن با پالت استاندارد رنگ ها. برای این کار از کاغذ لیتموس، کاغذ pH متر و شناساگرهای اسید و باز استفاده می شود.
- روش دقیق: با استفاده از دستگاه pH متر مقدار دقیق pH تعیین می شود.
از مواد شیمیایی تنظیم کننده های pH در چه جاهایی استفاده می شود؟
کاربرد تنظیم pH در صنایع مختلف یک امر ضروری است. از نمونه های مهم خنثی سازی و تنظیم اسیدیته می توان به خنثی سازی صنعتی آب آشامیدنی و تصفیه فاضلاب اشاره کرد. همچنین در صنایع غذایی به منظور افزایش ماندگاری مواد غذایی و بهبود طعم و مزه آن ها کاربرد دارد. در صنایع دارویی نیز از این روش به منظور تنظیم میزان pH داروها متناسب با اسیدیته محیط داخلی بدن و همچنین برای عملکرد بهتر مواد دارویی استفاده می شود.
اسیدهای متداول برای تنظیم pH
در این بخش لیستی از اسیدهایی که بیشترین کاربرد را در تنظیم pH و خنثی سازی دارند را ارائه می دهیم:
دی اکسید کربن
این ترکیب به خودی خود خاصیت اسیدی ندارد اما زمانی که با آب مخلوط می شود، کربنیک اسید تشکیل می دهد. استفاده از آن مشکل است و به همین دلیل در سیستم های خنثی سازی نسبت به موارد دیگر کمتر کاربرد دارد. اما از آن گاها در سیستم های تصفیه آب های معین استفاده می شود.
هیدروکلریک اسید
یکی از پرکاربردترین و معمول ترین اسیدها، HCl است. بعد از اسید سولفوریک این ترکیب دومین اسید مورد استفاده در صنعت است. هیدروکلریک اسید ارزان و موثر است (گرچه گرانتر از سولفوریک اسید است چرا قدرت اسیدی آن پایین تر است). غلظت بیش از 10 درصد بخاری که اسید کلریدریک ایجاد می کند در ترکیب با رطوبت بسیار خورنده است. این گاز می تواند باعث خوردگی فلزاتی مانند سیم های فولادی ضد زنگ و مس شود. از این ترکیب در تنظیم اسیدیته محلول ها استفاده می شود.
اسید نیتریک
اسید نیتریک اسید گرانتری از اسید کلریدریک و اسید سولفوریک است. این ترکیب نیز مانند HCl می تواند با رطوبت ترکیب شود و گاز خورنده ایجاد می شود. همچنین یک اکسید کننده است و در صورت وجود مواد آلی نباید از آن استفاده شود. در طی واکنش خنثی سازی نیز گرما آزاد می شود.
اسید فسفریک
اسید فسفریک یک اسید بی خطر است و اغلب در صنایع تولید مواد شوینده و کودهای کشاورزی استفاده می شود. ارزان است اما به اندازه HCl مقرون به صرفه نیست. به علت اینکه اسید ضعیف تری است، گازهای آزاد شده آن سمیت زیادی ندارد. واکنش خنثی سازی آن بسیار کند است و برای خنثی سازی در صنایع غذایی استفاده می شود. برای خرید اسید فسفریک با شماره های موجود در سایت تماس حاصل فرمایید.
اسید سولفوریک
این ترکیب جزو کم هزینه ترین و متداول ترین مواد شیمیایی خنثی کننده است. غلظت معمول آن بین 25 تا 96 درصد است. از همه اسیدها قوی تر بوده و از نیتریک اسید وهیدروکلریک اسید ایمن تر و کاربرد آن آسان تر است. واکنش خنثی سازی آن بسیار گرمازا است.
بازهای متداول برای تنظیم سازی pH
سدیم هیدروکسید
یکی از متداول ترین بازها برای انجام عمل خنثی سازی است. این ترکیب ارزان قیمت و ایمن است و حمل و نقل آن نیز آسان است.کاملا در آب محلول است و در نتیجه واکنش خنثی سازی نمک سدیم تولید می کند.
آمونیوم هیدروکسید
آمونیوم هیدروکسید یکی دیگر از بازهایی است که به منظور تنظیم pH مورد استفاده قرار می گیرد. اما استفاده از آن خیلی متداول نیست. چرا که استفاده از آن دشوار است، می تواند گازهای خورنده و خطرناک ایجاد کند. در صورت استفاده از آن باید در مخازن با تهویه مناسب نگهداری شود.
کلسیم هیدروکسید
یکی دیگر موادی که برای تنظیم اسیدیته استفاده می شود کلسیم هیدروکسید است. از آن به صورت دوغاب استفاده می شود و به همین علت استفاده از آن دشوارتر از بازهای دیگر است. میزان حلالیت آن در آب کم است. با این حال، زمان واکنش آن کمتر از هیدروکسید منیزیم است و از نظر اقتصادی نیز می تواند مقرون به صرفه باشد زیرا بسیار ارزان تر از NaOH است.
تنظیم کننده pH آب
اسید سولفوریک و هیدروکسید سدیم (سودآور) بیشتر برای خنثی کردن اسیدها یا بازها در آب استفاده می شوند. برای تنظیم pH باید احتیاط کرد زیرا این واکنش، یک واکنش گرمازا بوده ایجاد گرمای فراوان می کند. هر چه حجم کاربرد بیشتر باشد، گرمای بیشتری تولید می شود. مثلا؛ تنظیم pH آب لوله کشی گرمای بسیار کمی ایجاد می کند و مشکلی نیست اما تنظیم pH در حجم بالاتر از آن می تواند خطرناک باشد.
محلول های خنثی کننده با درصد اسیدی یا باز بالا می توانند گرمای قابل توجهی تولید کنند و بنابراین باید در طراحی و مواد مورد توجه قرار گیرند. متأسفانه در دنیای pH هیچ استانداردی وجود ندارد که بتوان از آن برای تنظیم pH در تصفیه آب استفاده کرد. تنظیم کننده های pH برای تصفیه آب شامل بسیاری از مواد شیمیایی است که مزایا و معایب متفاوتی دارند. از این تنظیم کننده به منظور تنظیم pH آب استخر، آب آشامیدنی، فاضلاب، صنعتی و… استفاده می شود.
جمع بندی
مواد شیمیایی تنظیم کننده pH ترکیباتی شیمیایی هستند که در صنایع مختلف از جمله صنعت تصفیه آب مورد استفاده قرار می گیرند. این ترکیبات عمدتا اسیدها و بازهایی هستند که قابلیت تنظیم خاصیت بازی و اسیدی آب و مواد دیگر را دارند. انواعی از مهم ترین این ترکیبات شامل سدیم هیدروکسید، کلسیم هیدروکسید، اسید کلریدریک، اسید سولفوریک، اسید نیتریک و… است. شما می توانید برای خرید مواد شیمیایی تنظیم کننده pH با ما در پتروکیمیا تماس بگیرید.
بیشتر بخوانید: آب دیونیزه چیست و چه کاربردی دارد؟