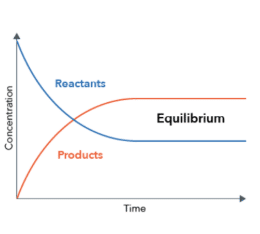
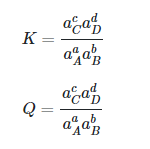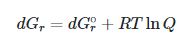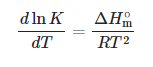تعادل شیمیایی چیست؟ زمانی که در یک واکنش شیمیایی مقدار غلظت واکنش دهنده ها و فرآورده ها در هر دو سمت معادله همواره ثابت باشد گفته می شود واکنش در تعادل شیمیایی است. این حالت زمانی اتفاق میوفتد که در یک واکنش برگشت پذیر، سرعت واکنش رفت و برگشت با هم برابر می شوند و غلظت ها به مقدار ثابتی می رسند که حتی با گذشت زمان، تمایل به تغییر ندارند.با توجه به نمودار، زمانی که غلظت واکنش دهنده ها و فراورده ها با زمان تغییر نمی کند تعادل شیمیایی حاصل شده است. تعادل شیمیایی یکی از حالت های تعادل ترمودینامیکی است و برای آنکه سیستم در تعادل ترمودینامیکی باشد باید تعادل های مکانیکی و گرمایی هم برقرار باشند.
فهرست عناوین
Toggleویژگی های یک سیستم در حال تعادل
- سرعت واکنش رفت با برگشت برابر است.
- سیستم بسته بوده و مبادله جرم با محیط ندارد.
- غلظت، رنگ و دیگر خواص ماکروسکوپی بدون تغییر هستند.
- در بررسی میکروسکوپی سیستم پویا است و واکنش رفت و برگشت در سطح مولکولی دائما انجام می شوند.
انواع تعادل شیمیایی
پیش از مطالعه در زمینه انواع نعادل های شیمیایی، ابتدا باید بدانیم چگونه می توان تعداد فازهای یک واکنش را مشخص کرد. برای این کار به نکات زیر توجه کنید:
- تمام گازهای موجود در یک واکنش، در کل یک فاز محسوب می شوند.
- فازهای محلول که با (aq) نشان داده می شود و فاز آب (l) در مجموع یک فاز محسوب می شوند.
- به تعداد مواد جامد موجود در واکنش، فاز جامد وجود دارد چرا مواد جامد نمی توانند با هم ادغام شوند و یک فاز یکسان را تشکیل دهند.
به عنوان مثال در واکنش هیدرولیز اسید بوریک، واکنش دهنده ها و فرآورده ها همه در یک فاز قرار دارند و فاز آبی دارند. همانطور که در معادله واکنش آن مشاهده می شود اسید بوریک دارای فاز محلول، آب فاز مایع و فرآورده آن نیز فاز محلول دارد. همانطور که پیش از این نیز اشاره کردیم زمانی که دو ماده در فاز محلول و آبی باشند، هم فاز هستند و یک فاز را تشکیل می دهند.
H3BO3 (aq) + H2O (l) ↔ H2BO3 (aq) + H+(aq)
به طور کلی دو نوع تعادل همگن (هموژن) و ناهمگن (هتروژن) وجود دارد:
تعادل شیمیایی همگن: در تعادل شیمیایی همگن واکنش دهنده ها و محصولات در یک فاز هستند و تعداد مولکول های واکنش دهنده و فراورده میتوانند باهم برابر یا متفاوت باشند:
H2 (g) + I2 (g) ⇌ 2HI (g)
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
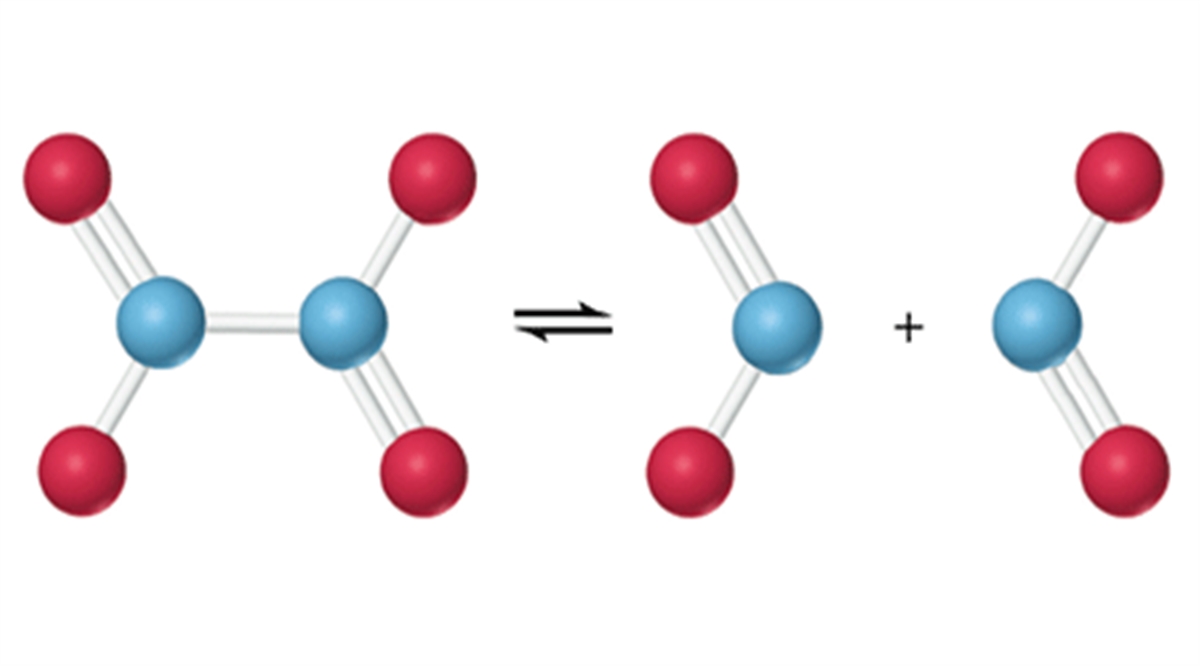
تعادل شیمیایی ناهمگن: در تعادل شیمیایی ناهمگن واکنش دهنده ها و محصولات در فازهای متفاوتی وجود دارند:
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
ثابت تعادل شیمیایی
Keq پارامتری بدون واحد است که بر اساس غلظت تعادلی واکنش دهنده ها و محصولات تعریف شده و به عواملی همچون دما و فشار وابسته است. این ثابت به وسیله ی تقسیم ثابت سرعت واکنش رفت بر ثابت سرعت واکنش برگشت هم قابل دستیابی است.
برای واکنش فرضی aA+bB⇌cC+dD ثابت تعادل به شکل زیر تعریف میشود:
Kc=[C]c[D]d / [A]a[B]b
که در آن [A], [B]، غلظت های تعادلی واکنشدهنده ها، [C], [D]، غلظت های تعادلی فرآورده ها (برحسب mol/l) و a,b,c,d ضرایب استوکیومتری معادله موازنه شده هستند.
با توجه به رابطه ی رو به رو میتوان از این پارامتر، انرژی آزاد گیبس را محاسبه کرد و به خود بخودی بودن یا غیر خودبخودی بودن واکنش پی برد.
به لحاظ ترمودینامیکی، G∆ در هنگام تعادل صفر است و کاهش H∆ و افزایش S∆ تعادل را در دو جهت رفت و برگشت، به صورت همزمان پیش می برد.
بیشتر بخوانید: تیتراسیون چیست؟ | انواع تیتراسیون
خارج قسمت واکنش
برای تعیین جهت پیشرفت واکنش زمانی که شرایط غیر تعادلی باشد از محاسبه خارج قسمت واکنش استفاده می شود.
برای محاسبه ی این کمیت باید فعالیت فراورده ها را بر واکنش دهنده ها تقسیم کرد که معمولا فعالیت مقداری برابر با غلظت دارد، در نتیجه:
Qc=[C]c[D]d / [A]a[B]b
تعادل شیمیایی و جهت پیشرفت واکنش
با استفاده از روابط ترمودینامیک می توان جهت واکنش را تشخیص و یا تعیین کرد. این امر با کمک سه مفهوم ثابت تعادل (K)، خارج قسمت (Q) و انرژی آزاد گیبس (ΔG) انجام می گیرد. روابط مربوط به تعادل و خارج قسمت در معادلات زیر مشاهده می شودکه در آن معادله aC و aD فعالیت مواد C و D هستند.
همچنین با استفاده از انرژی آزاد گیبس می توان ارتباط دو مقدار Q و T را محاسبه کرد که معادله آن به صورت زیر است. طبق این معادله هر وقت مقدار انرژی آزاد گیبس منفی باشد، واکنش به صورت خود به خودی و به سمت راست (جهت رفت)حرکت خواهد کرد. پس می توان گفت وقتی Q از K بزرگتر باشد محصول بیشتری تولید خواهد شد و طبق اصل لوشاتلیه برای رسیدن به نقطه تعادل، تعادل به سمت واکنش دهنده ها حرکت خواهد کرد.
بنابراین خواهیم داشت:
- Q=K: سیستم درحال تعادل است.
- Q>K: در این حالت فراورده بیشتری نسبت به حالت تعادل تشکیل شده است و طبق اصل لوشاتلیه واکنش در جهت تولید واکنش دهنده و مصرف فراورده برمی گردد.
- Q<K: در این حالت میزان واکنش دهنده ها بیشتر از مقدار تعادلیست و واکنش به سمت تولید فراورده پیش می رود.
عوامل موثر بر تعادل شیمیایی
تغییر غلظت، دما، فشار و افزودن کاتالیست می توانند تعادل را دستخوش تغییر کنند.بر اساس اصل لوشاتلیه، هرگاه تغیییری در تعادلات فیزیکی و شیمیایی ایجاد شود سیستم در جهت خنثی کردن یا کاهش این اثر و بازگشت به شرایط اولیه جابجا می شود.
تغییر غلظت
در اثر تغییر غلظت، ترکیب مخلوط در تعادل تغییر خواهد کرد. در صورتی که به غلظت یکی از اجزا اضافه شود واکنش در جهتی که آن را مصرف کند پیش میرود و اگر از مقدار و غلظت ماده ای کاسته شود واکنش در جهت تولید و جایگزینی آن جابجا خواهد شد.
تغییر فشار
تغییر فشار به دلیل تغییر حجم اتفاق می افتد و میتواند بر تعداد مولهای واکنش دهنده ها و محصولات گازی تاثیر بگذارد.
در حالت هتروژن، از تاثیر فشار بر مواد مایع و جامد صرف نظر می شود زیرا حجم آنها مستقل از فشار است.
تغییر دما
تاثیر تغییر دما بر تعادلات شیمیایی به علامت ΔH بستگی دارد، واکنش های گرمازا ΔH منفی دارند که با افزایش دما، تعادل (K) به سمت واکنش دهنده پیش می رود و ثابت تعادل آنها کاهش می یابد در حالی که واکنش های گرماگیر ΔH مثبت دارند که با افزایش دما تعادل به سمت محصول پیش می رود و ثابت تعادل نیز افزایش خواهد یافت. این اثر با نام معادله وانت هوف شناخته می شود که معادله آن در زیر مشاهده می شود:
اثر کاتالیزور
کاتالیزور بر تعادل شیمیایی تاثیری ندارد و سرعت واکنش رفت و برگشت را به یک میزان تحت تاثیر قرار می دهد. در حقیقت افزودن کاتالیزور تنها موجب افزایش سرعت به تعادل رسیدن واکنش می شود و واکنش با انرژی کمتری به انجام می رسد.
کاربرد تعادل شیمیایی
- تهیه آمونیاک: در فرایند هابر بر اثر اختلاط هیدروژن و نیتروژن، آمونیاک تشکیل میشود و واکنش تعادلی موجود در دمای پایین، فشار بالا و استفاده از کاتالیزور آهن بازده بهتری داشته و آمونیاک بیشتری تولید می کند.
N2(g)+3H2(g)⇌2NH3(g) ΔH=−92.4kJ/mol
- در تولید سولفوریک اسید: یکی از عمده ترین روش های تولید این ماده فرایند مجاورت است که اساس آن اکسیداسیون دی اکسید گوگرد به تری اکسید گوگرد است و شامل تعادل شیمیایی است.
- یکی دیگر از کاربردهای مهم تعادل شیمیایی در هموگلوبین خون وجود دارد. هموگلوبین می تواند با اکسیژن ترکیب شده و در نتیجه به بافت مختلف بدن خون برساند. واکنش ترکیب شدن هموگلوبین و اکسیژن یک واکنش برگشت پذیر و تعادلی است و تا زمانیکه در تعادل آن خللی ایجاد نشود، اکسیژن رسانی خون به درستی انجام می گیرد.
بیشتر بخوانید: اسمز معکوس به زبان ساده