تیتراسیون، که به عنوان تیترومتری نیز شناخته می شود ، یک روش آزمایشگاهی متداول در تجزیه و تحلیل کمی شیمیایی است که برای تعیین غلظت ناشناخته یک آنالیت شناسایی شده استفاده می شود. از آنجا که اندازه گیری حجم در آن نقش اساسی دارد ، به آن آنالیز حجمی نیز گفته می شود. معرفي به نام تيترانت يا تيتراتور به عنوان محلول استاندارد تهيه مي شود. غلظت و حجم شناخته شده تیترانت با محلول آنالیت یا تیترانت برای تعیین غلظت واکنش می دهد. به حجم تیتر واکنش داده شده ، حجم تیتراسیون گفته می شود. انواع مختلفی از تیترومتری با رویه ها و اهداف مختلف وجود دارد. متداول ترین انواع آن کیفی ، تیتراسیون اسید باز و اکسایش کاهش است.
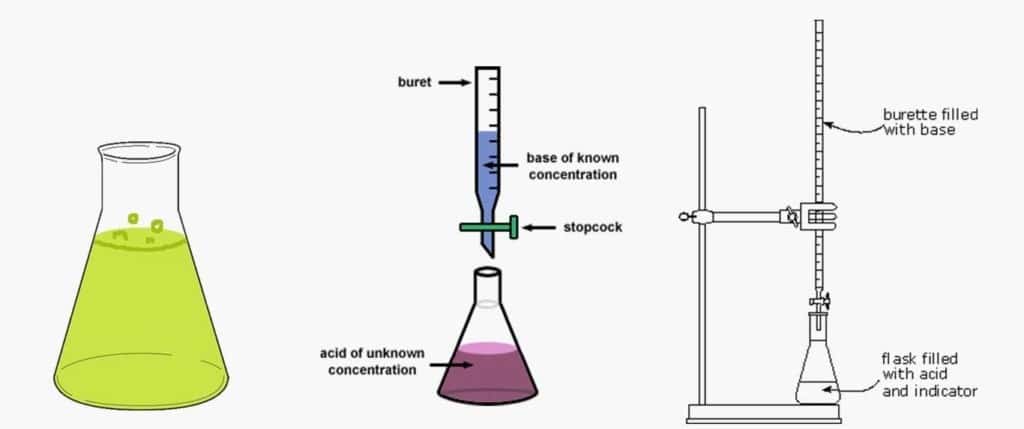
به عبارت دیگر آنالیز حجمی یک فرایند جهت تعیین مقدار برخی مواد در یک نمونه به وسیله ی ماده دیگر با غلطت مشخص است که در آن با توجه به نسبت استوکیومتری واکنش، مواد با هم واکنش میدهند و با رسیدن به نقطه ی هم ارزی واکنش به اتمام میرسد. در این روش آزمایشگاهی به ماده ای که غلظت مشخصی دارد و در بورت ریخته میشود تیترانت و به جزئی که در نمونه حضور دارد و هدف اندازه گیری آن است آنالیت گفته میشود که تیترانت و آنالیت باید درهم محلول باشند و در صورتی که نیاز به یک pH ثابت بود از بافر استفاده شود.
فهرست عناوین
Toggleاصطلاحات تیتراسیون
آنالیت یا نمونه: به محلولی که غلظت آن نامعلوم بوده و می خواهیم غلظت آن را تعیین کنیم آنالیت یا نمونه گفته می شود.
تیترانت: محلولی است که به عنوان استاندارد استفاده می شود و دارای غلظت و فرمول مشخص است و به منظور تعیین غلظت آنالیت استفاده می شود.
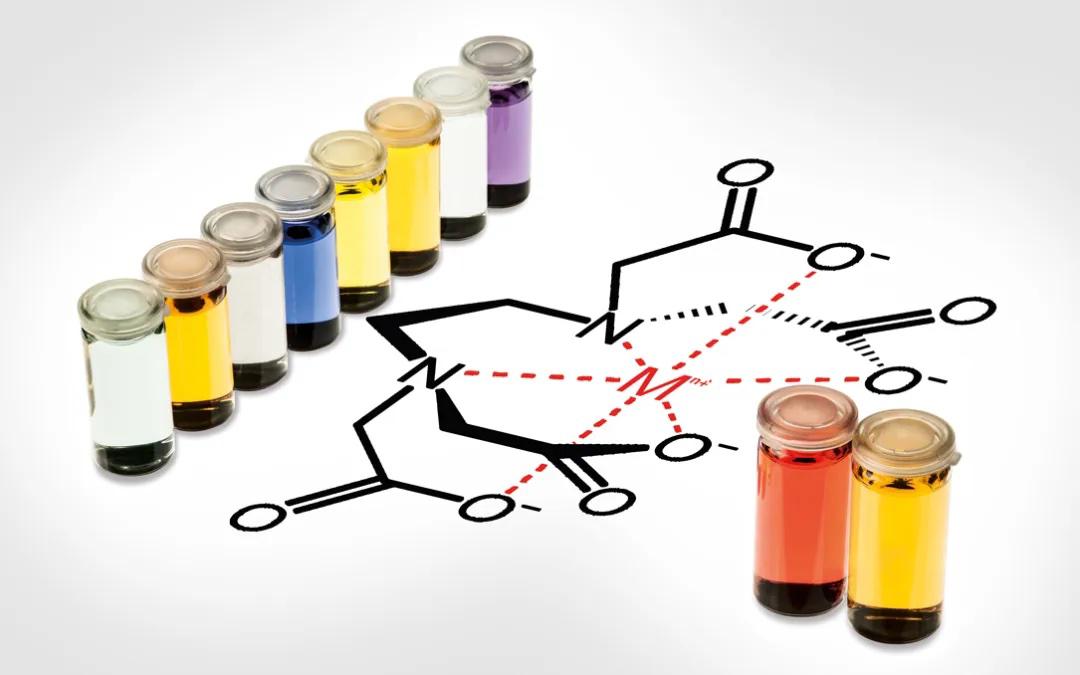
شناساگر: ماده ای است که در محیط های اسیدی و بازی تغییر رنگ می دهد و با تغییر رنگ آن می توان متوجه پایان واکنش تیترانت و آنالیت شد. این ترکیبات معمولا یک اسید یا باز ضعیف است.
نقطه هم ارزی در تیتراسیون چیست ؟
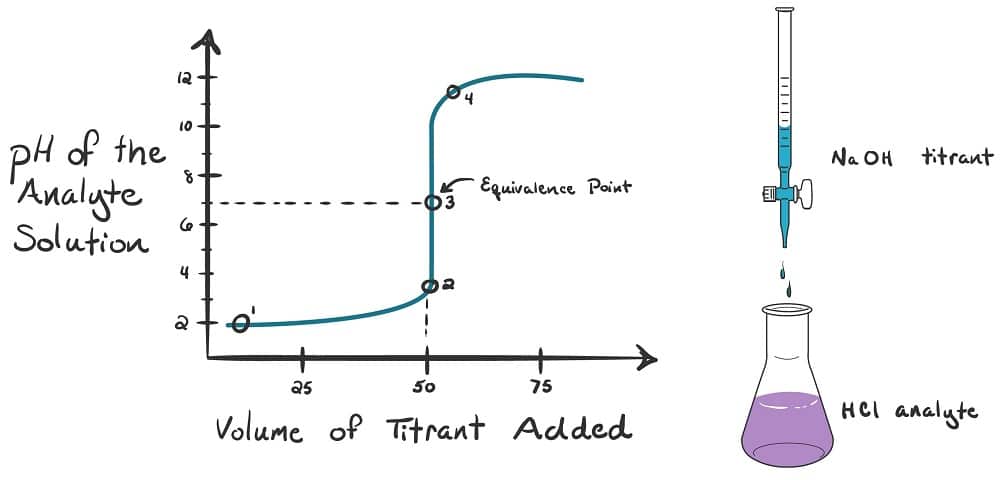
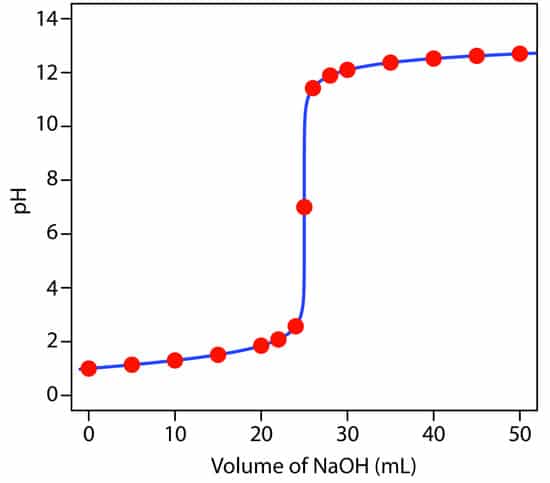
به نقطه ای که مقدار اکی والان های مساوی از تیترانت با آنالیت واکنش داده و طبق روابط استوکیومتری مشخص میشود نقطه هم ارزی گفته میشود، در حالی که هنگام آزمایش عملی نقطه ی پایانی تشخیص داده میشود و این نقطه معادل نقطه هم ارزی نیست و به اندازه ی اختلاف حجم بین این دونقطه خطای اندازه گیری وجود دارد.
برای هر واکنش اسید و باز باید شناساگر مناسبی که در نقطه ی هم ارزی تیتراسیون یا اطراف آن تغییر رنگ میدهد انتخاب شود. شناساگر ها موادی هستند که در هنگام واکنش بین تیترانت و انالیت با تغییر رنگشان خبر از اتمام واکنش و رسیدن به نقطه پایانی میدهند.
بیشتر بخوانید: تعادل شیمیایی چیست؟
تیتراسیون اسید و باز
تیتراسیون اسید و باز با توجه به غلظت و قوی یا ضعیف بودن واکنشگرها انجام میشود و نقطه ی هم ارزی به خنثی شدن اسید و باز توسط یکدیگر بستگی دارد. این فرایند شدیدا به pH بستگی داشته و در صورتی که اسید یا باز ضعیف وجود داشته باشد برای حصول جواب دقیق تر میتوان از pH سنج یا هدایت سنج استفاده کرد.
این روش در تهیه بیودیزل ها برای خنثی سازی روغن های مایع مصرفی در فرایند تولید استفاده می شود.
انواع تیتراسیون
انواع مختلفی از تیتراسیون ها وجود دارد که در اینجا به برخی از مهم ترین آن ها می پردازیم:
تیتراسیون اکسایش-کاهش
در این حالت واکنش اکسیداسیون احیا رخ میدهد و انتقال الکترون اتفاق می افتد که برای مشخص کردن نقطه ی پایانی از پتانسیومتر یا شناساگر مناسب بهره میبرند البته گاهی انقدر تغییر رنگ اجزای واکنش شدید است که نیازی به استفاده از معرف نیست مثل تیتراسیون یدومتری و پرمنگانومتری.
از این طریق میتوان غلظت اکسیژن موجود در آب را از واکنش سولفات منگنز و پتاسیم یدید محاسبه کرد به طوری که تا زمان حضور اکسیژن در آب، ید که محصول این واکنش است تولید خواهد شد.
تیتراسیون رسوبی
در این روش اساس کار تشکیل رسوب نامحلول از مواد معدنی است. به عنوان مثال در اثر اختلاط نیترات نقره با سدیم کلرید رسوب نقره کلرید تشکیل میشود که نشان دهنده ی اتمام واکنش است.
تیتراسیون کمپلکسومتری
در این روش بین آنالیت و تیترانت (فلز و لیگاند) یک کمپلکس ایجاد میشود و معمولا با حضور شناساگرهایی که با آنالیت کمپلکس ضعیف تشکیل میدهند انجام خواهد شد. این نوع حجم سنجی به دلیل عدم ایجاد هم رسوبی از روش رسوبی دقیق تر عمل میکند.
علاوه بر موارد بالا که نشان دهنده ی دسته بندی است موارد دیگری نیز جهت تعیین مقدار آنالیت قابل انجام است که در ادامه به آن ها می پردازیم:
فاز گازی
این روش در فاز گازی انجام میشوند بطوری که گونه های واکنش پذیر را از طریق واکنش با مقدار اضافی گاز که به عنوان تیترانت عمل میکند اندازه میگیرند.
مزایای تیترامتری فاز گازی:
- میزان اندازه گیری شده به طول مسیر بستگی ندارد.
- اندازه گیری به تغییر خطی جذب با غلظت آنالیت طبق قانون بیر-لامبرت بستگی نخواهد داشت.
- برای نمونه هایی که حاوی ناخالصی هایی که دارای تداخل در طول موج اندازه گیری هستند به شدت کاربرد دارند.
پتانسیل زتا
در این روش کامل شدن واکنش توسط شناساگر مشخص نمیشود، بلکه پایان واکنش به وسیله ی پتانسیل زتا تعیین میشود. این روش بیشتر برای مواد همگن کاربرد دارد.
تیتراسیون برگشتی
این تیتر کردن برعکس موارد دیگر انجام میشود به طوری که مقدار اضافی معرف استاندارد به محلول اضافه میشود و این مقدار اضافی تیتر میشود.
این روش هنگامی که شناسایی نقطه پایانی در حالت برگشتی آسان تر از حجم سنجی معمولی باشد کاربرد خواهد داشت. همچنین در حالتی که واکنش بین آنالیت و تیترانت کند انجام شود یا انالیت در یک جامد حل نشدنی باشد موثر خواهد بود.
منحنی تیتراسیون
برای تعیین نقطه ی پایانی از پارامترهای مختلفی میتوان استفاده کرد به طوری که یک مورد مشخص را در حین تیترومتری بررسی کرده و با توجه به رفتار آن، نقطه ی پایانی و در نتیجه میزان انالیت موجود در نمونه اندازه گرفته میشود. به عنوان مثال هدایت الکتریکی، PH، رسانایی، تشکیل رسوب، میزان جذب و … هریک به عنوان یک روش برای تحلیل حجم سنجی شناخته میشود.
در منحنی ها، محور x نشان دهنده ی حجم تیترانت اضافه شده و منحنی y نشان دهنده ی غلظت آنالیت در هر مرحله است. که برای تیتراسیون اسید و باز pH روی محور y قرار دارد و در صورتی که از اسید و باز قوی استفاده شود شیب تند در نقطه ی هم ارزی و تغییرات کم در طول نمودار ایجاد می شود.
برای تعیین غلظت یک جزء با این روش باید با استفاده از معادله ی N1.V1 = N2.V2 غلظت آنالیت مشخص شود.
به طوری که یک طرف تساوی به غلظت تیترانت که از ابتدای واکنش مشخص است و حجم استفاده شده از آن تا رسیدن به نقطه ی پایانی و طرف دیگر به نمونه که حجم معین و غلظت مجهول دارد تعلق میگیرد.
با جای گذاری مقادیر معلوم غلظت انالیت که مجهول است مشخص خواهد شد.
تیتراسیون علاوه بر علم شیمی در زیست شناسی هم برای تعیین غلظت ویروس ها و باکتری ها کاربرد دارد.
بیشتر بخوانید: مواد شیمیایی تنظیم کننده pH